O HNPCC - Câncer Colorretal Hereditário não Poliposo - é uma desordem genética, autossômica dominante. Tal deformação resulta em mutações em genes do DNA que fazem reparo do DNA type mismatch. Afeta um indivíduo em 500 a 2 000.
Série:
- Câncer - Principal Causa de Morte em 10% das Cidades Brasileiras
- Câncer - Homens são os que mais morrem
- Câncer - Envelhecimento e maior IDH influenciam
- Câncer - Aumento de 90% nas mortes desde 1998
Indivíduos com esta deformação possuem 80% a 90% de ter Câncer Colorretal durante toda a vida, bem como aumenta drasticamente o risco de Câncer do Endométrio, ovário, estômago, intestino delgado, vesícula biliar, na parte superior do aparelho urinário, cérebro e pele.
No caso do Câncer Colorretal, a malignidade não origina-se de pólipos, como é comum em outros casos de Câncer Colorretal. Acredita-se que aproximadamente cerca de 5% dos casos de Câncer Colorretal sejam causados por esta deformação. Indivíduos são diagnosticados, em média, aos 44 anos de idade. Em comparação, a idade média dos pacientes diagnosticados com Câncer Colorretal em geral é de 64 anos.
Não há um tratamento direto que cure HNPCC. Indivíduos com parentes com esta deformação podem optar por fazer um exame genético para comprovar a presença desta deformação. Indivíduos com alto risco de possuirem HNPCC incluem aqueles com parentes próximos (pais e irmãos) com a deformação, ou três ou mais parentes de sangue (afetando duas ou mais gerações familiares) afetados por Câncer Colorretal. Monitoramento rigoroso (colonoscopia anualmente, por exemplo) e cirurgia é utilizado para detectar e tratar cancros.
Suscetibilidade hereditária ao Câncer
A suscetibilidade hereditária pode ser claramente observada nas síndromes raras de câncer, onde fatores genéticos desempenham um papel preponderante. Estas síndromes podem ser identificadas pela presença, entre parentes próximos, de cânceres raros na população em geral (ex: retinoblastoma, neoplasia endócrina múltipla tipo 2A), ou devido à possibilidade de identificação se um padrão familiar de herança conhecido (ex: polipose adenomatosa familiar).
As observações epidemiológicas sobre a idade de manifestação mais precoce e o desenvolvimento de tumores bilaterais nas síndromes pediátricas de câncer, levaram Knudson a propor o modelo dos dois eventos para o desenvolvimento do câncer (1). De acordo com este modelo, é necessário haver inativação dos dois alelos de um gene supressor de tumor, como o gene do retinoblastoma (RB1), para que ocorra o desenvolvimento do câncer. Nos casos esporádicos de retinoblastoma, a inativação dos dois alelos do gene RB1 ocorre nas células somáticas (retinoblastos). Nos casos hereditários, a inativação (mutação) do primeiro alelo RB1 ocorre na linhagem germinativa, podendo ser herdado de um dos pais ou ser uma mutação nova. É necessário, no entanto, que ocorra a inativação somática (mutação ou perda de heterozigosidade) do segundo alelo para haver a manifestação da doença.
Alguns princípios gerais podem ser aplicados às síndromes hereditárias de câncer. Geralmente estão associadas a mutações germinativas em genes supressores de tumor. Mutações germinativas em proto-oncogenes são raras, como no caso da neoplasia endócrina múltipla tipo 2 (MEN2), associada ao proto-oncogene RET. Independente da classe de genes envolvidos, uma pessoa heterozigota (portadora) para uma mutação germinativa transmite o alelo mutado para 50% de seus filhos de ambos os sexos. Muitas síndromes hereditárias de câncer apresentam penetrância incompleta, ou seja, nem todos as pessoas portadoras do alelo mutante desenvolvem o câncer. A heterogeneidade genética também é comum, dificultando o seguimento clínico dos portadores. Na síndrome HNPCC, por exemplo, além de haver associação com pelo menos cinco genes envolvidos em reparo de DNA (MSH2, MLH1, MSH6, PMS1 e PMS2), a inativação de um destes genes pode resultar em grande variedade fenotípica entre indivíduos.
Atualmente, testes genéticos permitem identificar mutações em genes supressores de tumor associados, por exemplo, ao câncer hereditário de mama e/ou ovário (BRCA1 e BRCA2), ao câncer colorretal hereditário não poliposo (MSH2 e MLH1), à polipose adenomatosa familiar (APC) e à Síndrome de Li-Fraumeni e suas formas variantes (TP53). Os testes genéticos podem servir para diagnóstico molecular de uma síndrome hereditária em indivíduos afetados ou para identificar indivíduos heterozigotos (portadores) assintomáticos na família.
HNPCC
O Câncer Colorretal (CCR) é o quinto tipo de câncer mais freqüente no Brasil. Estima-se que o CCR hereditário represente 10% a 15% de todos os casos diagnosticados. Duas síndromes hereditárias de câncer colorretal têm sido mais investigadas: a Polipose Adenomatosa Familiar (FAP) e a Síndrome de Câncer Colorretal Hereditário não Poliposo (HNPCC). Enquanto a FAP é uma síndrome rara, representando menos de 1% dos casos de CCR diagnosticados, a síndrome HNPCC é a de maior incidência.
A Síndrome HNPCC é uma condição autossômica dominante associada a mutações em, pelo menos, cinco genes de reparo de DNA: MSH2, MSH6, MLH1, PMS1 e PMS2 (2, 3). O risco cumulativo para câncer colorretal (CCR) em indivíduos heterozigotos para mutações nos genes de predisposição à HNPCC é de aproximadamente 80% aos 80 anos. Dependendo da ausência ou presença de tumores extra-colônicos, a síndrome HNPCC tem sido classificada como Lynch I e II, respectivamente. O Câncer de Endométrio é a neoplasia extra-colônica mais frequentemente associada à síndrome de Lynch II, apresentando um risco cumulativo de 42% aos 80 anos. Além disto, o risco cumulativo para o desenvolvimento de outros tumores extra-colônicos, como os cânceres de estômago, de ovários e dos tratos biliar e urinário (19%, 9%, 18% e 10%, respectivamente), é maior do que o esperado ao acaso. Estima-se que nas famílias com a Síndrome de Lynch I, 40% apresente mutações em MSH2 e 30% em MLH1 (2). Mais de 100 mutações já foram descritas em MHS2, predominando substituições e pequenas deleções (4, 5).
Testes de DNA estão disponíveis para detecção de mutações nos genes MSH2 e MLH1, associados a até 90% dos casos de HNPCC.
Critérios para indicação de testes genéticos para os genes MSH2 e MLH1
A Síndrome de Lynch I, ou HNPCC clássica, apresenta critérios bem definidos estabelecidos por um Grupo Colaborativo Internacional em HNPCC (Critérios de Amsterdam I, 6). Critérios menos restritivos têm sido propostos por diferentes grupos, como os critérios de Bethesda (7) e os do ICG-HNPCC (Critérios de Amsterdam II, 8), considerando a presença de tumores extra-colônicos (Síndrome de Lynch II). Os critérios sugeridos para realização de testes moleculares para detecção de alterações nos genes MSH2 e/ou MLH1 são os seguintes:
• Critérios de Amsterdã I
- 1. CCR histologicamente confirmado em, pelo menos, três parentes, um dos quais parente em primeiro grau dos outros dois;
- 2. Pelo menos duas gerações sucessivas diagnosticadas com CCR;
- 3. Pelo menos um caso de CCR diagnosticado antes dos 50 anos, e
- 4. Exclusão clínica de FAP.
• Critérios de Amsterdã II
Famílias com pelo menos três parentes apresentando um dos cânceres associados a HNPCC (CCR, câncer de endométrio, intestino delgado, ureter ou pelve renal), sendo que:
- 5. Um deve ser parente em primeiro grau dos outros dois;
- 6. Pelo menos duas gerações sucessivas devam ser afetadas;
- 7. Pelo menos um caso de câncer deve ser diagnosticado antes dos 50 anos de idade;
- 8. O diagnóstico de polipose adenomatosa familiar deve ser excluído nos casos de CCR;
- 9. Os tumores devem ser verificados por exame anátomo-patológico.
• Critérios de Bethesda*
- 1. Indivíduos com CCR em famílias que preenchem os critérios de Amsterdã; ou
- 2. Indivíduos com dois cânceres associados ao HNPCC, incluindo CCR sincrônico e metacrônico ou cânceres extra-colônicos (endométrio, ovário, estômago, intestino delgado, hepatobiliar, pelve renal ou ureter); ou
- 3. Indivíduos com CCR e com um parente em primeiro grau com CCR ou com câncer extra-colônico associado ao HNPCC e/ou com adenoma colorretal; um dos cânceres diagnosticados antes dos 45 anos, e o adenoma diagnosticado antes dos 40 anos; ou
- 4. Indivíduos com CCR ou câncer de endométrio diagnosticado antes dos 45 anos; ou
- 5. Indivíduos com CCR no cólon direito com padrão histopatológico indiferenciado, diagnosticado antes dos 45 anos; ou
- 6. Indivíduos com CCR com padrão histopatológico em anel de sinete, diagnosticado antes dos 45 anos; ou
- 7. Indivíduos com adenoma diagnosticado antes dos 40 anos.
*A análise de MSI (instabilidade em microssatélites) é recomendável antes do encaminhamento para análise de mutações em MSH2 e MLH1.
Detecção precoce e prevenção
Devido ao espectro de tumores presentes nas famílias HNPCC, entre as medidas recomendadas para acompanhamento clínico de portadores assintomáticos destacam-se a colonoscopia a partir dos 20-25 anos a cada 1-3 anos, determinação de níveis de CA-125 e ultra-som pélvico e transvaginal, anualmente, a partir dos 25-35 anos para avaliação de endométrio e ovários. Outros métodos diagnósticos poderão ser discutidos dependendo dos tipos de tumores presentes na família (9). A recomendação de colectomia profilática para pessoas assintomáticas com mutação detectada é complexa e controversa, principalmente devido fato de que nem todos os indivíduos com mutação detectada desenvolvem CCR ao longo da vida, havendo um risco estimado de 70%. Além disto, há um risco de 12% de desenvolver câncer colorretal 4-6 anos após a colectomia e mortalidade de aproximadamente 1% devido à cirurgia (10).
A quimioprevenção e a modificação da dieta são opções a serem consideradas para pessoas com risco aumentado para CCR. Evidências laboratoriais, clínicas e epidemiológicas sugerem que uma dieta rica em cálcio pode reduzir o risco de recorrência de adenomas colorretais, provavelmente pelo efeito antiproliferativo sobre as células colônicas (11). Outros agentes investigados na quimioprevenção são a aspirina e os inibidores de Cox-2 (12). Diversos estudos epidemiológicos têm associado uma dieta rica em fibras (20-30 g/dia de acordo com recomendações do National Cancer Institute, Estados Unidos) com a diminuição do risco para câncer de cólon (13).
Aconselhamento genético
Considerando uma série de questões éticas, legais, sociais e psicológicas dos testes genéticos de predisposição ao câncer, é fundamental distinguir entre o benefício presumido e o benefício estabelecido para as pessoas que se submetem a estes testes. Os documentos resultantes do trabalho realizado pelo Ethical, Legal and Social Implications (ELSI) Branch do National Center for Human Genome Research orientam o aconselhamento genético de famílias, uma vez que discutem tanto os benefícios presumidos quanto as possíveis limitações das diversas intervenções clínicas (mamografia, cirurgias profiláticas, auto-exame de mamas, colonoscopia) recomendadas para avaliação de portadores.
Independente da realização de testes genéticos, o aconselhamento genético pode beneficiar os indivíduos e familiares preocupados com o risco de câncer, na medida que oferece informações e suporte para a adesão a programas de acompanhamento clínico e adoção de medidas preventivas.
Fotos no Google
Referências bibliográficas
1. Knudson AG (1971) Mutation and cancer: statistical study of retinoblastoma. Proc Natl Acad Sci USA 68: 820-823.
2. Marra G, Boland CR (1995) Hereditary nonpolyposis colorectal cancer: the syndrome, the genes, and historical perspectives. J Natl Cancer Inst 87: 1114-1125.
3. Miyaki M, Konishi M, Tanaka K, et al (1997) Germline mutation of MSH6 as the cause of hereditary nonpolyposis colorectal cancer. Nature Genet 17: 271-272.
4. Human Gene Mutation Database (http://www.uwcm.ac.uk/uwcm/mg/hgmd0.html).
5.Corvello CM, Bevilacqua RAU, Rossi BM, Simpson AJG (1999) A novel germline mutation at exon 7 of the MSH2 gene (1249delG) in a large HNPCC Brazilian kindred. Hum Mut 13: 506 (http://www.interscience.wiley.com/jpages/1059-7794).
6. Vasen HF, Mecklin J-P, Meeera Khan P, Lynch HT (1991) The International Collaborative Group on Hereditary Nonpolyposis Colorectal Cancer (ICG-HNPCC). Dis Colon Rectum 34: 424-425.
7. Rodriguez-Bigas MA, Boland CR, Hamilton SR et al (1997) A National Cancer Institute Workshop on Hereditary Nonpolyposis Colorectal Cancer Syndrome: meeting highlights and Bethesda guidelines. J. Nat. Cancer Inst. 89: 1758-1762.
8. Vasen HF, Watson P, Mecklin J-P, Lynch HT (1999) New clinical criteria for Hereditary Nonpolyposis Colorectal Cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative Group on HNPCC. Gastroenterology 116: 1453-1456.
9. Burke W, Petersen G, Lynch P et al (1997) Recommendations for follow-up care of individuals with an inherited predisposition to cancer. I. Hereditary nonpolyposis colorectal cancer. JAMA 277: 915-919.
10. Rodriguez-Bigas MA (1996) Prophylactic colectomy for gene carriers in hereditary nonpolyposis colorectal cancer. Cancer 78: 199-201.
11. Baron JA, Beach M, Mandel JS, et al (1999) Calcium supplements for the prevention of colorectal adenomas. New Eng J Med 340: 101-107, 1999.
12. Kelloff GJ, Hawk ET, Crowell JA et al (1996) Strategies for identification and clinical evaluation of promising chemopreventive agents. Oncology 10: 1471-1480.
13. Vargas PA, Alberts DS (1992) Primary prevention of colorectal cancer through dietary modification. Cancer Suppl 70: 1229-123.
Comente e compartilhe este artigo!
APROFUNDE-SE MAIS
Leia Também:
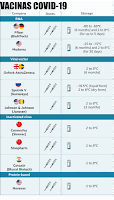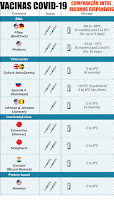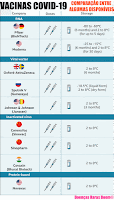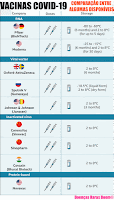
Vacinas COVID-19
Sanofi e GSK
Moderna
Pfizer-BioNTech
Covishield
Sputnik V
Comparação
Tópicos sobre Coronavírus
- Esse vírus é uma Pandemia. O que isso significa?
- É verdade que o vírus não sobrevive no calor?
- Tomar chá quente mata o vírus? Evitar boca seca mata o vírus?
- Quantas pessoas sobrevivem ao coronavírus?
- O que fazer para nos proteger?
- Os seres humanos podem ser infectados com um novo Coronavírus de origem animal?
- Devo usar Máscara Facial para me Proteger?
- Como ocorreram as primeiras infecções humanas pelo novo Coronavírus?
- O COVID-19 é transmitido pelo ar?
- Há Risco em Circular de Transporte Público?
- Qual é o risco real de se contrair o Corona Vírus viajando de avião?
- Qual seria a melhor maneira de deixar nossas casas seguras?
- De que forma espera-se que esse surto termine?
- Quanto tempo o vírus resiste sobre superfícies?
- Quando fazer a Higienização das roupas e dos sapatos ao chegarmos em casa?
- Colocar os produtos que comprei na geladeira não é suficiente para matar os vírus?
- No que diz respeito aos Produtos de Limpeza, o que se deve fazer para evitar Intoxicação?
- É correta a preocupação devido a percepção de uma Taxa de Mortalidade relativamente baixa?
- Superfícies Contaminadas, preciso realmente me preocupar?
- Sites que mostram Dados - Mortes, Curva de Contágio e Mutações - em Tempo Real
- O que fazer na Quarentena?
- O que Fazer se Tiver falta de ar?
- Quando o Diagnóstico for Confirmado
- O que fazer se estiver com sintomas leves?
- O que fazer diante da possibilidade de tantos sintomas?
- O que os Principais Sintomas: Tosse, Febre e Falta de Ar, Querem Dizer?
- Como se Pega ? Quais são os Sintomas ? Como se proteger?
- O que é ? De onde veio ? Como surgiu?


















Nenhum comentário:
Postar um comentário