Comercializado sob o nome comercial Lutathera®, o medicamento atua ligando um radionuclídeo a um análogo da somatostatina, que é absorvido por NETS que possuem os receptores SSTR2.
O Lutathera® é administrado por uma infusão intravenosa e, à medida que os tumores absorvem a medicação radiomarcada, ela libera radiação para a célula cancerosa e a destrói internamente.
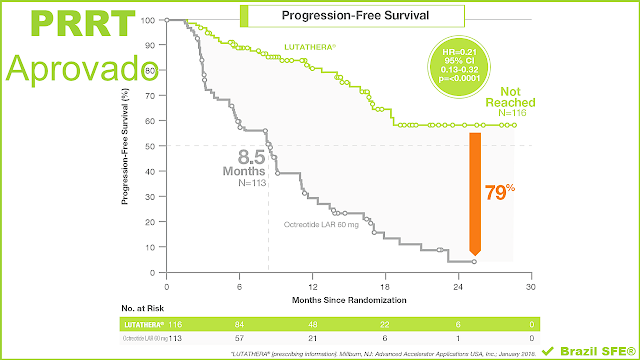
Em 2014, os dados dos estudos NETTER-1 atingiram o seu endpoint primário, mostrando uma redução de 79% no risco de progressão da doença ou morte, em comparação com a terapia de octreotide de 60 mg de ação prolongada. Muitos pacientes não são diagnosticados no início de sua doença, pois os sintomas tendem a ser vagos ou diagnosticados erroneamente por anos, antes que o paciente tenha apresentação clínica avançada. Esta nova terapia dá esperança aos pacientes que não são elegíveis para tratamentos devido à progressão avançada.
O Lutathera® recebeu designação de Medicamento Órfão do FDA e da EMA - Agência Europeia de Medicamentos.
O Lutathera® foi administrado a mais de 2.000 pacientes com um uso compassivo e nomeou a base do paciente para o tratamento de TNEs e outros tumores que expressam em excesso os receptores de somatostatina em 10 países Europeus e nos EUA sob um Programa de Acesso Expandido (EAP).
Como em todos os tratamentos, pode haver efeitos colaterais, sendo os mais comuns a Linfopenia (níveis baixos de linfócitos), aumento do dano hepático com níveis elevados de gama-glutamil transferase, aspartato aminotransferase elevada e alanina aminotransferase, bem como vômitos, náuseas, hiperglicemia (níveis elevados de açúcar no sangue) e hipocalemia (potássio sérico elevado).
O Centro mais versado em terapia PRRT nos EUA é a Universidade de Iowa e o Excel Diagnostics, em Houston.
O PRRT também foi dado como terapia durante os ensaios NETTER-1 pela Mayo Clinic Rochester, que foi ampliado para oferecer esta nova opção de tratamento. A Northwoods NETS está animada em ver esse tratamento finalmente reconhecido para uso nos Estados Unidos, pois proporciona um novo tratamento e esperança para pacientes que, de outra forma, tenham esgotado outras terapias. Foi aprovado para todos os Tumores Neuroendócrinos de Intestino Anterior, Médio e Posterior, em adultos.
Maiores detalhes aqui. Por favor, veja as informações completas sobre prescrição aqui.
Referências:
Dasari A, C. Shen, Halperin D, B Zhao, Zhou S, Y Xu, Shih T, Yao JC. Tendências na incidência, prevalência e sobrevida em pacientes com tumores neuroendócrinos nos Estados Unidos. JAMA Oncol. 2017; 3 (10): 1335-1342.
Yao JC, Hassan M, Phan A, et al. Cem anos após o "carcinóide": epidemiologia e fatores prognósticos para tumores neuroendócrinos em 35.825 casos nos Estados Unidos. J Clin Oncol. 2008; 26: 3063-3072.
LUTATHERA ® [informação de prescrição]. Millburn, NJ: Aplicativos Advanced Accelerator USA, Inc .; Janeiro de 2018.
#AAA #EMA #FDA #Lutathera #NETS #Novartis #Peptideos #PRRT #Radionuclídeos #SSTR2 #Tumores #TumoresNeuroendocrinos
Deixe seus comentários, compartilhe este artigo!⬛◼◾▪ Social Media ▪◾◼⬛⬛◼◾▪ Blogs ▪◾◼⬛• SFE® • SFE Tech® • SFE Terms® • SFE Books® • SFE Biography®
⬛◼◾▪ CONTATO ▪◾◼⬛

Nenhum comentário:
Postar um comentário